
хБех║╖щЖлчЩВч╢▓я╝ПшиШшАЕцЫ╛цнгш▒кха▒х░О

чФЯчЙйчЫ╕ф╝╝шЧешИЗхн╕хРНшЧе(generic)цШпф╕НхРМчЪДя╝МчФЯчЙйчЫ╕ф╝╝шЧецШпх╛Юц┤╗ч┤░шГЮф╛Жшг╜щАая╝МшАМхн╕хРНшЧецШпч░бхЦочЪДхМЦхн╕хРИцИРуАВ
щЪишСЧхОЯх╗ачФЯчЙйшг╜хКСя╝ИхЦоцакцКЧщлФщбЮчнЙхдзхИЖхнРшЧечЙйя╝ЙхЬих░ИхИйф┐Эшн╖хИ░цЬЯф╣Лх╛Мя╝МхЕ╢ф╗ЦшЧех╗ацИЦчФЯчЙйчзСцКАхЕмхП╕х░ЗхПпхИйчФих╖▓цЬЙцХ╕цУЪя╝Мф╛ЖчФЯчФвуАМчФЯчЙйчЫ╕ф╝╝шЧея╝ИBiosimilarя╝ЙуАНуАВф╕НхРМцЦ╝х░ПхИЖхнРхн╕хРНшЧея╝МчФЯчЙйчЫ╕ф╝╝шЧечЪДщЦЛчЩ╝щЦАцк╗цЫ┤щлШя╝МхдЪхо╢хдЦхХЖшг╜шЧещЦЛчЩ╝х╗ах░ЗхКахЕечИнхекчФЯчЙйчЫ╕ф╝╝шЧец▓╗чЩВх╕Вха┤уАВ
цЧехЙНхП░чБгшЧечЙйч╢Уц┐ЯцЪицХИцЮЬчаФчй╢хн╕цЬГшИЙш╛жф║ЖуАОчФЯчЙйчЫ╕ф╝╝шЧешлЦхгЗуАПя╝МщВАшлЛхЬЛхдЦщвиц┐ХхЕНчЦлчзСцХЩцОИFrank van den HoogenщЖлх╕ля╝МхИЖф║лчФЯчЙйчЫ╕ф╝╝шЧечЪДшЗих║КшйжщйЧч╢УщйЧя╝Мф╜ЬчВ║хЬЛхЕзщЖлчХМф╜┐чФичФЯчЙйчЫ╕ф╝╝шЧечЪДхАЯщПбуАВ
щЭЮхн╕хРНшЧе уААуАМчФЯчЙйчЫ╕ф╝╝шЧеуАНхпйца╕циЩц║ЦщлШ
чФЯчЙйчЫ╕ф╝╝шЧешИЗхн╕хРНшЧе(generic)цШпф╕НхРМчЪДя╝МчФЯчЙйчЫ╕ф╝╝шЧецШпх╛Юц┤╗ч┤░шГЮф╛Жшг╜щАая╝МшАМхн╕хРНшЧецШпч░бхЦочЪДхМЦхн╕хРИцИРуАВхЫацндчФЯчЙйчЫ╕ф╝╝шЧечЪДщЦЛчЩ╝чиЛх║ПчЫ╕ш╝ГцЦ╝хн╕хРНшЧецЫ┤чВ║шдЗщЫЬя╝Мф╣ЯцЬЙцЫ┤хКач╣БшдЗчЪДц│ХшжПхпйца╕циЩц║ЦуАВчФЯчЙйчЫ╕ф╝╝шЧешг╜чиЛф╕нцЬЙхдзч┤Д250 щаЕшг╜чиЛф╕нхУБш│кцквц╕мя╝МчЫ╕ш╝ГцЦ╝х░ПхИЖхнРхн╕хРНшЧехЙЗхГЕщЬАч┤Д50щаЕцквц╕муАВ
ф╗Ащ║╝цШпуАМчФЯчЙйшг╜хКСуАНя╝ЯуААф╗Ащ║╝цШпуАМчФЯчЙйчЫ╕ф╝╝шЧеуАНя╝Я
хОЯх╗ачФЯчЙйшг╜хКСх░▒хе╜цпФф╕АхеЧховшг╜хМЦше┐шгЭя╝МхЬичммф╕АцмбшиВшг╜цЩВя╝МхЫачВ║щЬАшжБщЗПш║луАБцЙУчЙИхПКшгБч╕ля╝МцЙАф╗ещЬАшжБчЪДцЩВщЦУхПКшК▒ш▓╗чЫ╕х░Нф╛ЖшккцШпцЬАхдЪчЪДя╝МшАМчФЯчЙйчЫ╕ф╝╝шЧея╝Мх░▒хжВхРМшг╜ф╜Ьф╕АхеЧхЙкшгБф╕АцигчЪДцЙЛх╖еше┐шгЭя╝Мф╕НщБОхЫачВ║цЬЙхПГшАГчЙИхЮЛя╝МхЫацндф╕НщЬАшжБхЖНшК▒цЩВщЦУщЗНцЦ░щЗПш║лшиВхБЪуАВщАЩф╣ЯцШпчФЯчЙйчЫ╕ф╝╝шЧечВ║ф╗Ащ║╝шГ╜цпФчФЯчЙйшг╜хКСчпАчЬБщЖлчЩВцИРцЬмчЪДф╕╗шжБхОЯхЫауАВ
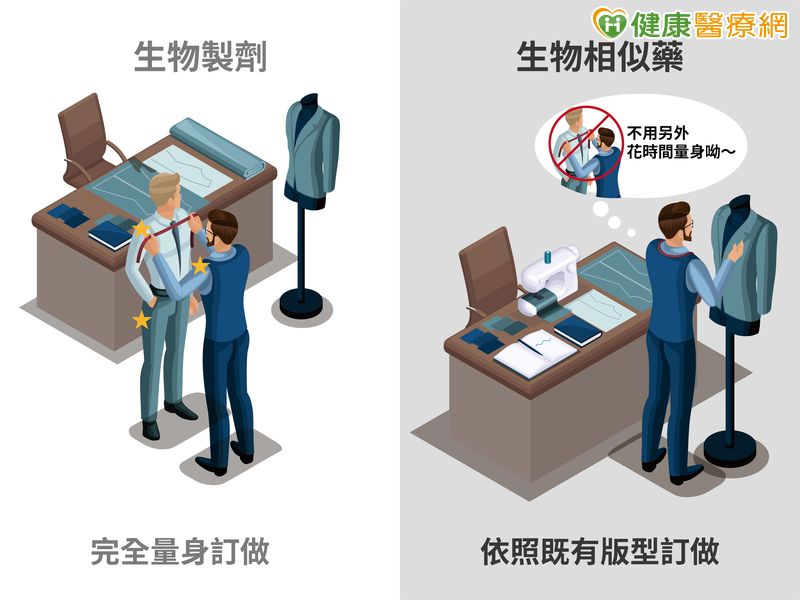
чФЯчЙйчЫ╕ф╝╝шЧеуААхоЙхЕицАзуАБчЩВцХИшИЗхПГшАГшЧехУБчЫ╕чХ╢
чФЯчЙйчЫ╕ф╝╝шЧечЪДщЦЛчЩ╝чЫочЪДя╝МцШпчВ║ф║Жшг╜щАахЗ║шИЗхПГшАГшЧехУБхЬихоЙхЕицАзхТМчЩВцХИф╕КчДбшЗих║Кх╖очХ░чЪДчФЯчЙйшг╜хКСшЧеуАВшАМщЩНф╜ОцИРцЬмчЪДщЧЬщН╡хЬицЦ╝ф╕НщЬАшжБхГПхОЯхПГшАГхУБх░НцЦ╝цпПф╕АхАЛщБйцЗЙчЧЗщГ╜щЬАшжБщА▓шбМхдзшжПцибшЗих║КшйжщйЧя╝МхПкшжБцЬЙхоМцХ┤чЪДхн╕чРЖца╣цУЪуАБч░бхМЦчЪДшЗих║КшйжщйЧф╗ехПКхЕНчЦлц┤╗цАзхИЖцЮРя╝Мх░▒хПпф╗ещАПщБОцУ┤х▒ХщБйцЗЙчЧЗчЪДцЦ╣х╝Пя╝МхПЦх╛ЧхТМхОЯхПГшАГхУБф╕АцигчЪДщБйцЗЙчЧЗца╕хЗЖчпДхЬНуАВхЫацндя╝МчФЯчЙйчЫ╕ф╝╝шЧечЪДф╕Кх╕Вя╝МцЬЙхКйцЦ╝цПРф╛ЫщЖлх╕лхТМчЧЕцВгцЫ┤хдЪч╢Уц┐ЯчЪДц▓╗чЩВщБ╕щаЕуАВ
ш╖ихЬЛхОЯщЦЛчЩ╝шЧех╗ачаФчЩ╝уААуАМчФЯчЙйчЫ╕ф╝╝шЧеуАНхУБш│кчййхоЪ
Frank van den HoogenцХЩцОИцПРхПКя╝МчФ▒цЦ╝чФЯчЙйчЫ╕ф╝╝шЧечаФчЩ╝шГМх╛Мшг╜щАах╗ацШпшЧех╗ая╝МхдзхдЪцХ╕щГ╜цШпш╖ихЬЛцАзчЪДхОЯщЦЛчЩ╝шЧех╗ая╝Мф╣ЯхЕ╖хВЩчЫ╕чХ╢цИРчЖЯчЪДчФЯчЙйшг╜хКСчаФчЩ╝шИЗчобчРЖшГ╜хКЫя╝МхЫацндя╝МщАЩф║ЫшЧех╗ашг╜щАачЪДчФЯчЙйчЫ╕ф╝╝шЧехУБш│кхНБхИЖчййхоЪя╝МцЙНшГ╜чН▓х╛ЧщЖлчЩВчХМш╢│хдачЪДф┐бш│┤уАВ
цЬмхЬЦ/цЦЗчФ▒уАМхБех║╖щЖлчЩВч╢▓уАНцОИцмКхИКчЩ╗я╝МщЭЮч╢УхРМцДПф╕Нх╛Чф╗╗цДПш╜Йш╝ЙуАВ
хОЯцЦЗхЗ║шЩХя╝ЪуАМчФЯчЙйчЫ╕ф╝╝шЧеуАНцЩВф╗гф╛ЖшЗия╝БуААщЧЬщН╡чВ║хУБш│кф╕АшЗ┤цАз


